Riporto di seguito il testo di un mio recente articolo pubblicato su la rivista Il Minotauro, Anno XLV – n.2 Dicembre 2018
Il potere delle aspettative: effetto placebo, effetto nocebo
“No hay medicina que cure lo que no cura la felicidad.”
Gabriel García Márquez
La citazione in epigrafe, del grande scrittore sudamericano, potrebbe erroneamente indurre a credere che la prospettiva esposta sia relegabile al mondo della letteratura, governato – si sa – da leggi più flessibili di quelle vigenti nella nostra realtà. Pertanto, per ovviare a tale rischio, inizio questa trattazione riportando le parole del noto neurofisiologo italiano Fabrizio Benedetti, tratte dalla prefazione alla sua ultima pubblicazione (2018):
Oggi la scienza ci dice che le parole sono delle potenti frecce che colpiscono precisi bersagli nel cervello e il corpo di chi soffre. È questo il concetto chiave che sta emergendo, recenti scoperte lo dimostrano: le parole attivano le stesse vie biochimiche di farmaci come la morfina e l’aspirina, ma visto che nel corso dell’evoluzione sono nate prima le parole e poi i farmaci, è più corretto dire che i farmaci attivano gli stessi meccanismi delle parole (p.1).”
L’opera, intitolata “La speranza è un farmaco. Come le parole possono vincere la malattia”, divulga la decennale esperienza di uno dei massimi esperti internazionali sul tema “placebo”, ed il passo racchiude in sé in estrema sintesi la relazione tra comunicazione, aspettative ed effetti somatici. Nel corso dell’articolo ripercorrerò, attraverso pubblicazioni scientifiche sia di Benedetti che di altri autori le motivazioni che sempre più portano la Scienza a riscoprire ciò che l’Arte ha sempre saputo. Ma andiamo per ordine.
Cosa significa effetto placebo (e nocebo)
Entrambi i termini ‘placebo’ e ‘nocebo’ derivano dal latino: il primo, risalente a fine XVII secolo, significa letteralmente ‘ciò che piacerà’ e deriva da ‘placere’; il secondo, apparso negli anni ’60 del secolo scorso, col significato di ‘ciò che causerà danno’, deriva da ‘nocere’ (cfr.www.oxforddictionaries.com). La stessa fonte definisce ‘placebo’ con la duplice accezione di “a substance that has no therapeutic effect, used as a control in testing new drugs” e di “a medicine or procedure prescribed for the psychological benefit to the patient rather than for any physiological effect”; e definisce ‘nocebo’ come “a detrimental effect on health produced by psychological or psychosomatic factors such as negative expectations of treatment or prognosis”.
Le due accezioni del termine ‘placebo’ introducono due distinte prospettive: la prima, inerente la ricerca clinica e maggiormente diffusa, è stata ampiamente studiata per valutare l’efficacia di un trattamento farmacologico; la seconda, utilizzata da secoli nella pratica medica, incontra un più recente interesse, volto alla comprensione dei meccanismi di efficacia ed il loro eventuale impiego terapeutico. Benedetti (2012) così riassume:
Fino a pochi anni fa l’effetto placebo era considerato un artefatto noioso e costoso nella ricerca clinica, in cui è necessario paragonare un gruppo di pazienti sottoposto al trattamento vero da sperimentare con uno sottoposto ad un trattamento finto (il placebo). Questo paragone è reso necessario dal semplice fatto che spesso i pazienti che prendono il placebo mostrano un miglioramento della loro malattia. […] L’attenzione si è sempre focalizzata sulla differenza fra i gruppi di pazienti che prendono la terapia vera e quelli che prendono la terapia finta: se i primi migliorano più dei secondi, la terapia sotto esame è considerata efficace, e quindi può essere approvata dalle diverse agenzie di controllo (p. 9).
L’autore prosegue affermando che “solo negli ultimi anni i ricercatori si sono chiesti seriamente come mai la somministrazione di un placebo, e quindi di una terapia finta, potesse indurre dei miglioramenti clinici” (p. 9), e perché alcune situazioni producono effetti clinici negativi.
Il pionieristico lavoro del medico tedesco Adolf Binger (1918) , effettuato su 937 pazienti affetti da difterite, confronta, in uno studio in doppio cieco, l’antitossina difterica ed un siero di controllo da essa indistinguibile; sebbene le validità delle osservazioni di Binger sia poco chiara (Tröhler, 2011), lo studio è rivoluzionario poiché riconosce per la prima volta la possibile influenza delle aspettative sull’efficacia farmacologica (Benedetti, 2012). Negli anni ’50, ha grande impatto sulla comunità scientifica l’articolo The Powerful Placebo, del medico anestesista di Harvard Henry Knowles Beecher (1955). Beecher si interessa al fenomeno negli anni della Seconda Guerra Mondiale, quando, medico militare, si trova in scarsità di antidolorifici e decide di sostituirli con iniezioni di acqua distillata o di soluzione salina, scoprendone l’efficacia in circa un terzo dei casi (Benedetti, 2013a).
Negli stessi anni lo psicologo tedesco Bruno Klopfer riporta in un articolo (1957) il caso clinico di un collega, il medico Philip West: il signor Wright, affetto da un grave tumore, dopo aver letto di un nuovo promettente farmaco ancora in fase sperimentale, il Krebiozen, si convince della sua miracolosità e, sebbene privo dei requisiti richiesti, tanto insiste che riesce ad ottenerne la somministrazione. Nonostante sugli altri pazienti il farmaco non mostri alcun risultato apprezzabile, il signor Wright recupera velocemente le energie, e la massa tumorale regredisce rapidamente; finché legge di notizie discordanti sull’effettiva efficacia del Krebiozen ed ha una ricaduta. Il medico ne rimane impressionato e decide di rassicurare il paziente che il farmaco funziona, che i dubbi di cui ha letto sono dovuti unicamente a delle confezioni deteriorate, alle quali va imputato anche il suo peggioramento, e che presto l’ospedale ne riceverà di purissimo. Trascorso qualche giorno gli inietta acqua distillata ed il paziente nuovamente migliora, al punto che presto viene dimesso. Infine l’American Medical Association annuncia la definitiva inefficacia del farmaco, il signor Wright ne è informato dai giornali, nuovamente peggiora, viene ricoverato e dopo due giorni muore.
Naturalmente un singolo caso clinico ha scarso valore scientifico, tuttavia la storia del signor Wright merita di essere riportata poiché è spesso citata negli studi sulla suggestione e perché l’articolo in cui è menzionata ha certamente interesse storico, avendo ampiamente contribuito a diffondere l’interesse sul tema (Harrington, 2009).
Il placebo nella scienza moderna
Come già accennato, la scienza può interessarsi all’effetto placebo per confrontarvi l’effetto di una terapia, oppure può studiarlo di per sé, indagarne i meccanismi di azione ed interrogarsi sulle sue possibili applicazioni. Le due prospettive, come afferma Benedetti (2014b) danno adito ad ambiguità:
The still persisting confusion and misconception within the scientific community about the word placebo come from the different meaning that this word has for the clinical trialist and the neuroscientist. In fact, the former is mainly interested in comparing a therapy with a placebo and to establish whether the therapy is superior to the placebo. […] Conversely, the neuroscientist wants to isolate the psychobiological component from the spontaneous fluctuations of the symptom, the patient’s biased reports, and the experimenter’s biased measurements (p. 623).
Lo studio neuroscientifico del fenomeno richiede quindi distinzioni più precise di quelle bastanti ad un trial farmacologico, per il quale può essere sufficiente definire ‘effetto placebo’ ogni aspetto non direttamente imputabile all’assunzione del farmaco. Un’ampia pubblicazione del British Medical Journal, The Science of the Placebo: Toward an Interdisciplinary Research Agenda (Guess, Kleinman, Kusek, & Engel, 2002), delinea più chiaramente il fenomeno. Innanzitutto non sono considerabili effetto placebo né le variazioni dovute a remissione spontanea, né quelle imputabili al fenomeno di regressione verso la media, né quelle legate alle difficoltà di valutazione di un sintomo, né quelle dovute alla tendenza a compiacere gli sperimentatori o a variabili intervenienti.
Alcuni di questi effetti confondenti sono relativamente controllabili dalle condizioni sperimentali; più difficile è tuttavia distinguere tra una guarigione imputabile all’efficacia di un farmaco, ad effetto placebo, o a remissione spontanea. Un comune raffreddore, ad esempio, ha un decorso tipico di cinque giorni ed un miglioramento dopo il secondo giorno; e per isolare gli effetti dovuti a remissione spontanea servirebbe, oltre al gruppo sperimentale e quello placebo, anche un gruppo di controllo nel quale la malattia svolge naturalmente il suo corso. Per quanto ciò sia possibile nella sperimentazione per la cura del raffreddore, difficilmente il disegno di studio sarebbe approvato da una commissione etica se finalizzato allo studio di gravi patologie, per le quali inoltre il normale decorso è spesso meno conosciuto. La distinzione può essere ininfluente per un trial clinico che valuta l’efficacia di un farmaco, ma è importante nello studio del placebo (Benedetti, 2012).
Dopo aver precisato cosa l’effetto placebo non è, la già citata pubblicazione del British Medical Journal include nella sua definizione sia la somministrazione di una sostanza inattiva nascondendone al soggetto la natura, sia la somministrazione di una sostanza attiva a sua insaputa, sia ogni stimolo dovuto alla procedura, al setting o al linguaggio (Guess, Kleinman, Kusek, & Engel, 2002).
Numerose dinamiche di funzionamento sono state teorizzate. Lo psicologo dell’University of Arizona, Richard Bootzin, ipotizza un’interazione tra meccanismi comportamentali, cognitivi e socioculturali (Bootzin & Caspi, 2002).
L’antropologo statunitense Daniel Moerman ed il collega Wayne Jonas introducono il concetto di ‘meaning response’ (Moerman & Jonas, 2002); scrivono: “We propose a new way to understand those aspects of medical care, plus a broad range of additional human experiences, by focusing on the idea of “meaning”, to which people, when they are sick, often respond”. (p. 471). Per gli autori, “placebos are inert. You can’t do anything about them. For human beings, meaning is everything that placebos are not, richly alive and powerful” (p. 474); i miglioramenti clinici a seguito di somministrazione di placebo sarebbero pertanto dovuti al significato che la ‘terapia’ ha per il paziente; significato che sarebbe sempre attivo ed agirebbe in ogni aspetto di un evento clinico, vero o finto, convenzionale o alternativo che sia. Dunque, una migliore comprensione di tale meccanismo “will probably lead to far greater insight into how treatment works and perhaps to real improvements in human well-being” (p. 471).
Lo psicologo canadese Shepard Siegel (2002) ritiene che in alcuni casi l’effetto placebo sia mediato da condizionamento pavloviano. Della stessa opinione è anche lo psicologo americano Robert Ader (dai cui studi nasce la disciplina nota come PNEI – Psiconeuroendocrinoimmunologia) che ipotizza una sinergia tra farmaco ed effetto placebo, in luogo del consueto confronto tra le due condizioni sperimentali. Ader sostiene infatti (Ader et al., 2010) che in alcuni casi l’effetto placebo “looks like” la risposta ad uno stimolo condizionato: il farmaco costituirebbe stimolo incondizionato; la risposta fisiologica ad esso, risposta incondizionata; il placebo stimolo condizionato. L’ipotesi trova supporto in una ricerca (Voudouris, Peck, & Coleman, 1990) che mostra la possibilità di condizionare la risposta ad una finta pomata antidolorifica presentata ai soggetti come efficace per alleviare il dolore provocato da una scarica elettrica. Come prevedibile alcuni dei soggetti sottoposti all’esperimento riportano un dolore meno intenso, mentre altri non rispondono al placebo; se tuttavia a questi ultimi si ripete alcune volte la procedura, riducendo a loro insaputa l’intensità della scarica elettrica e facendogli così credere che la pomata funzioni, anch’essi percepiscono come non dolorosa una scarica di forte intensità quando associata alla finta crema antidolorifica.
Principalmente “two main mechanisms have been the focus of attention: expectation and learning” (Benedetti, 2014b, p. 625). Relativamente ai percorsi biologici, si ritengono implicati sia l’asse HPA (Eskendari & Sterberg, 2002) che gli oppioidi endogeni e il sistema dopaminergico (Scott DJ et al., 2008). Come emerge da un recente studio (Krummenacher, Candia, Folkers, Schedlowski, & Schönbächler, 2010) sull’analgesia prodotta da placebo, la corteccia prefrontale sembra fortemente implicata, poiché disturbandone l’attività tramite stimolazione magnetica transcranica se ne inibisce l’effetto.
Lo studio del placebo comporta due importanti difficoltà, la prima di carattere etico, la seconda metodologica. La Dichiarazione di Helsinki (World Medical Association, 2013), redatta dall’Associazione Medica Mondiale, e costantemente aggiornata a partire dal 1964, anno della sua prima stesura, prevede all’articolo 33 che “a new intervention must be tested against those of the best proven intervention” (p. 2193). L’articolo estende al caso specifico della sperimentazione il principio generale che “a physician shall act in the patient’s best interest when providing medical care” (p. 2191), e consente l’uso del placebo con estrema cautela e unicamente nei casi in cui non sia disponibile un trattamento efficace; il paziente non riceva alcun danno serio o irreversibile dal mancato trattamento; o sia ritenuto indispensabile il confronto col placebo per testare la sicurezza del trattamento stesso. Sebbene alcune interpretazioni ne aumentino in parte la flessibilità, l’autorizzazione delle commissioni etiche agli studi sul placebo segue ampiamente la Dichiarazione di Helsinki (Temple, 2002). Anche per questa motivazione la maggior parte degli studi che hanno dimostrato l’efficacia del placebo come terapia attiva sono stati effettuati sul controllo del dolore o su patologie minori.
Pur con questa limitazione, esistono protocolli sperimentali ampiamente utilizzabili. Il più diffuso consiste nel somministrare di nascosto una terapia tradizionale, distinguendo così tra la sua componente specifica (l’effetto del farmaco) e l’aspettativa psicologica, nel rispetto dell’assicurare al paziente il miglior trattamento farmacologico disponibile. Se ad esempio la somministrazione di un antidolorifico ad un paziente post-operatorio, solitamente accompagnata da parole rassicuranti del personale ospedaliero, non fosse influenzabile dalla componente psicologica, iniettarlo a sua insaputa dovrebbe essere ugualmente efficace, mentre si è visto che così non è (Colloca, Lopiano, Lanotte, & Benedetti, 2004). Entrambe le condizioni offrono al paziente lo stesso trattamento, e l’aspetto etico può essere risolto ottenendo il consenso del paziente a ricevere un farmaco, un placebo, o nessun trattamento; in modo che somministrandogli il farmaco di nascosto ritenga di trovarsi nella condizione di nessun trattamento e non abbia aspettative di efficacia. Altri esempi sono offerti dall’interruzione della somministrazione endovenosa di un antidolorifico (decisa dal medico per motivi clinici) dopo comunicazione al paziente o a sua insaputa; oppure il farmaco può essere somministrato attraverso una cannula attivata da un computer dopo un tempo non noto al paziente, cui viene chiesto l’andamento dei sintomi. Particolarmente interessante è infine il disegno di studio chiamato placebo bilanciato, nel quale i soggetti sono divisi in quattro gruppi che rispettivamente ricevono il farmaco vero o il placebo, e gli viene detto la verità o il suo opposto (Benedetti, 2012).
Per ovvi motivi etici la sperimentazione sull’effetto nocebo risulta ulteriormente problematica ed è solo raramente applicabile allo studio di patologie; per quanto le conoscenze delle dinamiche di apprendimento consentano di affermare che “humans and animals can learn in a number of ways, including observation and imitation. Pain is powerfully influenced by social interactions, so its modulation by observation can be as effective as for other perceptions and behaviors” (Benedetti, 2013b, p. 1165). L’ipotesi è confermata da un recente studio che ha mostrato la possibilità di indurre iperalgesia tramite apprendimento osservazionale (Vögtle, Barke, & Kröner-Herwig, 2013). Studi osservazionali ed epidemiologici supportano inoltre la tesi che l’effetto nocebo sia socialmente contagioso, e pericolosamente influente sulla salute individuale, tramite, ad esempio: gli esagerati allarmi diffusi dai media; l’anticipazione di effetti collaterali, come quelli attesi dalla chemioterapia o riportati nel bugiardino di un farmaco; o l’impatto psicologico di una diagnosi negativa (Hahn, 1997).
Studi effettuati in alcune patologie
La ricerca sugli effetti di trattamenti placebo in patologie gravi, come ad esempio il tumore del già citato caso del signor Wright, è preclusa, o ampiamente limitata, per motivi etici. In casi simili, la reale influenza delle aspettative non può pertanto essere stimata sperimentalmente, e l’avvenimento in questione rimane un episodio aneddotico, non confermabile, né smentibile dalla ricerca.
Ciò nonostante un recente articolo, pubblicato sul Lancet (Finniss, Kaptchuk, Miller, & Benedetti, 2010), afferma che:
Laboratory evidence supports the existence of several placebo mechanisms and placebo effects in both healthy volunteers and patients with a variety of medical conditions. Furthermore, clinically relevant evidence shows that placebo effects can have meaningful therapeutic effects, because of their long magnitude and duration, in different patient populations (p. 693).
Dallo stesso articolo è tratta la Figura 1, che schematizza i percorsi biologici noti, attivati sia da trattamenti convenzionali che da effetto placebo, in alcune condizioni di salute:

Similmente Benedetti (2008) riassume nella tabella 1 l’azione dell’effetto placebo/nocebo, in alcune patologie ed alcuni sistemi organici, limitandosi ai casi in cui sono noti i percorsi biologici:

Il controllo del dolore rappresenta l’ambito maggiormente studiato e l’efficacia di interventi basati sul placebo ha trovato molte conferme, sia sfruttando le aspettative dei soggetti, sia tramite condizionamento (Price et al., 1999). L’azione analgesica appare legata alla produzione di oppioidi endogeni, ipotesi supportata dal suo mancato prodursi in caso di contemporanea somministrazione di antagonisti, come il nalaxone (Amanzio & Benedetti, 1999); sebbene su pazienti affetti da sindrome dell’intestino irritabile l’analgesia indotta da placebo appaia indipendentemente dall’iniezione intravenosa di farmaci antagonisti (Vase, Robinson, Verne, & Price, 2005). Un altro mediatore biologico noto è la colecistochinina (CCK), infatti un suo antagonista, il proglumide, aumenta l’analgesia da placebo (Benedetti, 1997); mentre in uno studio sulla iperalgesia indotta da nocebo il farmaco ne inibisce l’effetto, probabilmente per il ruolo svolto dalla colecistochinina nell’ansia anticipatoria, che favorirebbe l’effetto nocebo (Benedetti, Amanzio, Casadio, Oliaro, & Maggi, 1997). Uno studio italiano (Amanzio, Pollo, Maggi, & Benedetti, 2001), effettuato su 278 pazienti post-operatori, cui vengono somministrati antidolorifici (morfina, buprenorfina, tramadolo, ketorolac, o metamizolo), rileva che la dose di farmaco necessaria ad alleviare il dolore è superiore del cinquanta percento se l’iniezione avviene all’insaputa del paziente, mostrando un forte effetto delle aspettative nel controllo del dolore. La differenza di efficacia della somministrazione di antidolorifici nelle condizioni overt o covert è mostrata anche da uno studio condotto su pazienti affetti da morbo di Alzheimer (Benedetti et al., 2006); nessuna differenza tra le due condizioni è tuttavia rilevata nei soggetti che riportano una ridotta attività delle zone corticali prefrontali, suggerendo quindi che l’effetto placebo sia mediato degli aspetti cognitivi da esse controllati.
Una patologia in cui l’effetto placebo è ampiamente studiato è il morbo di Parkinson, nel quale sembra essere coinvolta l’attivazione dopaminergica del sistema di ricompensa endogeno, ed in particolare del nucleo accumbens (De la Fuente-Fernández, 2009); mentre la stimolazione cerebrale profonda dei nuclei subtalamici, nelle condizioni in cui la macchina è accesa o spenta ed i pazienti ne sono o meno a conoscenza, supporta “the role of expectation and placebo effects in STN-DBS [Sub-thalamic nucleus–deep brain stimulation] in Parkinson’s disease patients” (Mercado et al., 2006, p. 1457).
Una meta-analisi effettuata su 75 trial clinici con gruppo di controllo a placebo, effettuati su pazienti psichiatrici trattati per disturbo depressivo maggiore (Walsh, Seidman, Sysko, & Gould, 2002), mostra l’efficacia del placebo in media nel 29.7% dei casi. L’effetto, pur inferiore a quello ottenuto dai farmaci antidepressivi, è così importante che un editoriale del British Journal of Psychiatry (Andrews, 2001) scrive: “the size of the response to placebo might well be a bane to researchers and to the drug industry but, properly handled, it is surely a boon to busy clinicians and their patients” (p. 193). Lo stesso articolo sottolinea l’importanza di ricorrere a gruppi di controllo placebo nello studio della depressione; ed una meta-analisi sul rischio suicidario di tali pazienti (Khan, Warner, & Brown, 2000) conclude che “our data indicate that depressed patients in clinical trials who are assigned to placebo treatment are not at greater risk for suicide or suicide attempts than those assigned to active treatment” (p. 317). Uno studio che, tramite tomografia a emissione di positroni, ha misurato il metabolismo cerebrale del glucosio, in gruppi di pazienti sottoposti a sei settimane di flouxetina o di sostanza inerte ma creduta efficace (Mayberg et al., 2002), ha rilevato “the combination of dorsal-cortical increases and limbic-paralimbic decreases in glucose metabolism, with response to both drug and placebo intervention” (p. 734), sebbene il farmaco intervenga anche su altre aree (ippocampo e tronco encefalico, corpo striato e insula anteriore).
Uno studio in doppio cieco su soggetti in trattamento per disturbo di ansia sociale (Furmark et al., 2008) mostra una buona risposta alla condizione placebo, abbinata alla riduzione dell’attività dell’amigdala, nei portatori dell’allele l del gene 5-HTTLPR e nei portatori dell’allele G del gene TPH2; mentre non si produce nei portatori degli alleli s o T, suggerendo quindi un effetto mediato dal sistema serotoninergico. L’efficacia del placebo sulla riduzione di stati ansiosi trova conferma anche in una ricerca che espone i soggetti ad immagini spiacevoli e vi abbina, per ridurre l’intensità delle emozioni provocate, il primo giorno una benzodiazepina ed il giorno successivo una sostanza inerte apparentemente identica al farmaco (Petrovic et al., 2005). Nello stesso studio:
event-related fMRI demonstrated that the same modulatory network, including the rostral anterior cingulate cortex and the lateral orbitofrontal cortex, is involved in both emotional placebo and placebo analgesia. These effects were correlated with the reported placebo effect and were predicted by the amount of treatment expectation induced on a previous day. Thus, the placebo effect may be considered to be a general process of modulation induced by the subjects’ expectations (p. 957).
Relativamente al sistema cardiovascolare, uno studio (Pollo, Vighetti, Rainero, & Benedetti, 2003) mostra che l’analgesia da placebo è accompagnata dalla riduzione della frequenza cardiaca; che la somministrazione di nalaxone blocca sia l’effetto analgesico che la riduzione dell’attività beta-adrenergica; che la somministrazione di propranololo, un farmaco betabloccante, inibisce quest’ultima ma non l’analgesia; mentre l’assenza di effetti del blocco dei recettori muscarinici, tramite atropina, suggerisce che il sistema parasimpatico non sia coinvolto.
Nel sistema respiratorio, una ricerca (Benedetti, Amanzio, Baldi, Casadio, & Maggi, 1999) mostra che l’ipoventilazione provocata dall’assunzione di buprenorfina, un farmaco analgesico ad effetto narcotico, può essere indotta da placebo, dopo ripetute somministrazioni del farmaco. Anche in questo caso l’azione è legata al sistema oppioide endogeno, poiché impedita dalla somministrazione di nalaxone. L’effetto, che non è consapevole nei soggetti che la manifestano, appare inoltre mediato da condizionamento classico.
Come già riportato, in molti casi l’effetto placebo è imputabile a condizionamento pavloviano, ed a tale meccanismo si ritengono imputabili gli effetti riscontrati sul sistema immunitario. Tra le prime osservazioni della possibilità di condizionare il sistema immunitario figura un articolo di fine ‘800 (McKenzie, 1886), che riferisce di alcune reazioni allergiche alla vista di fiori finti. I primi studi scientifici risalgono tuttavia alla ben nota ricerca di Ader e Cohen (1975); mentre la prima conferma di risultati analoghi nell’uomo è dovuta ad una ricerca tedesca (Goebel et al., 2002) che dimostra la possibilità di indurre immunosoppressione (risposta condizionata) a seguito dell’ingestione di una bevanda inerte (stimolo condizionato), precedentemente associata ad un farmaco immunosoppressivo, la ciclosporina (stimolo incondizionato). Di pochi anni successiva è un’analisi delle letteratura degli effetti del placebo sul sistema immunitario (Pacheco-López, Engler, Niemi, & Schedlowski, 2006), che conclude affermando: “research on placebo effects with regard to immune-related diseases is scarce, but there are consistent indications that skin and mucosal inflammatory diseases are strongly modulated by placebo treatments”. Nonostante i risultati riportati, e la raccomandazione di effettuare ulteriori ricerche, non mi risultano articoli più recenti sull’argomento.
Effetti analoghi sono stati osservati nel sistema endocrino da uno studio sulla possibilità di condizionare la produzione di cortisolo e di ormone della crescita, tipicamente influenzata dall’assunzione di sumatriptan, un agonista dei recettori 5-HT1B/1D (Benedetti et al., 2003), che riporta che “placebo administration after sumatriptan preconditioning mimicked the effects of the sumatriptan itself” (p. 4321), e che “it is important to point out that these sumatriptan-like effects occurred regardless of whether verbal suggestions were given for GH increase or decrease. Thus verbal manipulations that are likely to affect expectations did not influence hormonal secretion” (p. 4321).
Il ruolo dell’aspettativa si incontra invece nuovamente negli effetti osservati su gruppi di soggetti dipendenti da cocaina, cui viene somministrato un placebo o un farmaco psicostimolante, il metilfenidato, nelle quattro condizioni in cui sono informati della reale sostanza assunta, o viceversa; lo studio osserva un maggiore incremento del metabolismo cerebrale del glucosio se i soggetti ritengono di assumere il farmaco, sia che effettivamente lo sia, sia che non lo sia (Volkow et al., 2003).
Tra i più sorprendenti effetti clinici prodotti dal placebo figurano quelli dimostrati dalla cosiddetta ‘sham surgery’, nella quale il paziente anestetizzato riceve l’incisione, e gli altri aspetti necessari ad una normale operazione chirurgica, in assenza di un reale intervento sugli organi interni.
Il primo trial clinico a confrontare gli esiti di questo tipo di intervento con quelli di una reale operazione chirurgica risale al 1959, anno in cui Leonard Cobb, cardiologo della University of Washington, valuta la reale efficacia della legatura bilaterale dell’arteria mammaria, in pazienti affetti da angina pectoris. La pratica, allora molto diffusa per migliorare il flusso cardiaco dei pazienti, è stata abbandonata quando i risultati dello studio ne hanno mostrano un’efficacia non superiore a quella di un finto intervento (Cobb, Thomas, Dillard, Merendino, & Bruce, 1959). Risultati altrettanto clamorosi, ancora una volta su pazienti che soffrono di disturbi coronarici, ma in tempi più recenti, sono riscontrati da una ricerca sull’ampiamente utilizzata rivascolarizzazione transmiocardica laser-indotta (Leon et al., 2005), che così conclude: “treatment with percutaneous myocardial laser revascularization provides no benefit beyond that of a similar sham procedure in patients blinded to their treatment status” (p. 1812).
Analogamente, uno studio sulla adesiolisi laparoscopica, in pazienti affetti da dolori addominali (Swank et al., 2003), mostra che “although laparoscopic adhesiolysis relieves chronic abdominal pain, it is not more beneficial than diagnostic laparoscopy alone” (p. 1247); e pazienti che soffrono di artrosi al ginocchio migliorano a seguito delle pratiche di lavaggio o di debridement artroscopico quanto quelli sottoposti a finta chirurgia (Moseley et al., 2002).
Di particolare interesse sono i risultati di uno studio condotto su pazienti in stato avanzato di morbo di Parkinson, che confronta il trapianto nel cervello di cellule embrionali produttrici di dopamina, con la sola procedura di anestesia, trapanatura del cranio ed inserzione del lungo ago che nel reale intervento ha la funzione di contenere le cellule (McRae et al., 2004). Gli autori concludono che:
there were more differences and changes over time in QOL [Quality of Life] among perceived treatment groups than among actual treatment groups. Medical staff, who did not know which treatment each patient received, also reported more differences and changes at 12 months based on patients’ perceived treatment than on actual treatment (pp. 418-419).
Nonostante il forte effetto placebo riscontrato dagli articoli citati in alcune pratiche chirurgiche – che in fondo alla luce di quanto già riportato sul potere terapeutico delle aspettative non stupisce, dato che in genere nessuno si fa operare se non è profondamente convinto dell’efficacia dell’intervento – il confronto in doppio cieco è spesso considerato non etico, e pertanto scarsamente impiegato in chirurgia, a causa degli inevitabili rischi inerenti ogni operazione, vera o falsa che sia. Di diversa opinione è il membro del dipartimento di bioetica del National Institutes of Health statunitense, Franklin Miller (2004), il quale sottolinea che “innovative surgical procedures typically are introduced into clinical practice without rigorous evaluation of their efficacy” (p. 157); e che in un bilancio etico dovrebbe essere attentamente considerata anche la possibile non eticità di anestesie ed interventi chirurgici effettuati senza una conferma della loro efficacia.
La questione, spinosa e molto complessa, non è ad ogni modo centrale al tema di questo articolo, come invece lo sono due aspetti che, malgrado le forti limitazioni cui è sottoposta, la ricerca ha mostrato:
– risposte a placebo, tramite aspettative consce del paziente e/o condizionandone alcuni meccanismi, intervengono in molte situazioni cliniche;
– l’effetto, in virtù delle molte conferme ottenute, lungi dall’essere mero strumento di confronto, suggerisce un suo diretto impiego terapeutico; come illustrato nel prossimo paragrafo.
Considerazioni
Riassumendo con le parole di Benedetti (2014a): “a placebo is the entire ritual of the therapeutic act” (p. 329) e “humans are endowed with endogenous systems that can be activated by verbally induced positive expectations, therapeutic rituals, healing symbols, and, more generally, by social interactions” (p. 329).
L’antropologo e epidemiologo statunitense Robert Hahn, in Sociocultural model of Illness and Healing (1985), ritiene che l’insieme di questi simboli, rituali ed interazioni sociali, costituisca un substrato capace di influenzare la salute dell’individuo. Provocatoriamente scrive:
It is unlikely that belief in the healing power of large doses of arsenic would transform this chemical into a healing agent; yet I submit, though I will not attempt to prove it, that such a belief would retard its poisonous effects. Likewise, lack of faith in antibiotics may diminish the potency of these drugs, and faith or scepticism about pharmacologically inert materials or practices may shift the results in expected directions (p. 185).
Così ridefinita, la risposta placebo sembra includere anche quei meccanismi di influenza, ben noti alla psicologia sociale (cfr. ad esempio: Myers, 2012), che per quanto qui non riportati offrirebbero ulteriore supporto a favore della sua efficacia.
Da una prospettiva filosofica (ma pubblicata sulla prestigiosa Nature Reviews Neuroscience), è interessante la tesi (Colloca & Benedetti, 2005) secondo cui la misurazione dell’azione di un trattamento risentirebbe di un effetto simile a quello ben noto in fisica col nome di principio di indeterminazione di Heisemberg. Per esporre la loro tesi, gli autori prendono a prestito i risultati di una precedente ricerca (Benedetti, Amanzio, & Maggi, 1995) che, secondo un classico studio randomizzato in doppio cieco confronta l’efficacia antidolorifica del proglumide, un farmaco antagonista della colecistochinina, con quella di una sostanza placebo, o di nessun trattamento. Poiché la condizione sperimentale comporta una riduzione del dolore, statisticamente significativa, superiore a quella del trattamento placebo (a sua volta superiore alla condizione di assenza di trattamento), si potrebbe concluderne la sua efficacia sui percorsi neurali del dolore. La conclusione sarebbe tuttavia errata perché, nello stesso studio, la somministrazione di proglumide alla totale insaputa del paziente non presenta nessuna proprietà antidolorifica, mostrando quindi un’efficacia del farmaco nell’aumentare la risposta placebo dovuta all’aspettativa di ricevere un antidolorifico, tramite la quale, e non direttamente, agisce. L’indeterminatezza cui si collega l’articolo deriverebbe dal fatto che:
When we give a painkiller, we cannot be certain that it acts on the pain pathways, as it might also, or only, act on the expectation pathways (the uncertainty principle). Indeed, almost all pharmacological substances might act on the neurotransmission of the expectation pathways (p. 550).
La risposta placebo è presente, sia nell’uomo che negli animali, in misura variabile da individuo ad individuo (Scott et al., 2007); in modo probabilmente influenzato da polimorfismi genetici (Benedetti et al., 2003), da tratti di personalità (Geers, Helfer, Kosbab, Weiland, & Landry, 2005), e dalla funzionalità della corteccia prefrontale (Benedetti et al., 2006). La diversa reattività è ad ogni modo influenzabile, e sono stati sviluppati dei protocolli per indurre una risposta placebo nei soggetti che ad un primo esperimento non la presentano (cfr. pp. 62-63); come pure procedure per ridurne l’effetto in uno studio clinico, in cui i soggetti disimparano a rispondere (Benedetti, 2012). Sebbene non sia chiaro quanto e se ciò sia realmente auspicabile, “infatti, eliminare da un trial clinico tutti coloro che rispondono bene al placebo non sembra essere una procedura metodologicamente corretta, visto che i pazienti rimasti non rappresenterebbero la popolazione generale, la quale include sia i reattivi che i non reattivi” (pp. 47-48).
La soppressione della risposta placebo, dubbia nella ricerca, sarebbe certamente fuori luogo nella pratica clinica, nella quale, sola, o congiunta alla normale terapia, può al contrario rappresentare un prezioso alleato (Benedetti, 2013a). La complessa interazione medico-paziente può essere riassunta, da una prospettiva psicologica, nella figura 2:
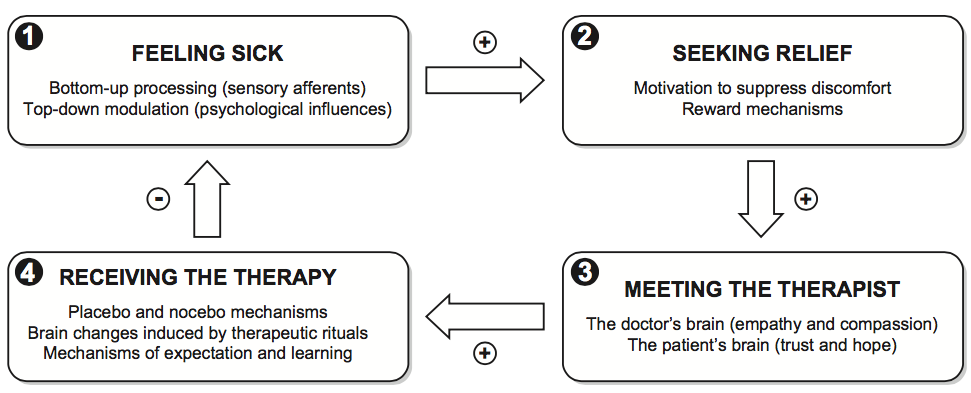
Si tratta di un sistema omeostatico, nel quale ogni aspetto contribuisce, o meno, alla guarigione del paziente; tanto se viene consapevolmente impiegato a tal fine dal medico e dalla struttura sanitaria, quanto se è invece lasciato a se stesso. Afferma Benedetti (2013a) che:
It is crucial to understand that this system is always at work, regardless of whether the healer administers effective or ineffective therapies. Even if the therapy is totally ineffective, the patient’s expectation of benefit (the placebo response) may be sufficient to inhibit discomfort. The real difference between shamans and modern doctors is that, whereas shamanic procedures are likely to lack specific effects completely, at least in most circumstances, modern doctors rely on effective procedures and medications with specific mechanisms of action. But this social-neural system is always there, as an ancestral system which is ready to come out, both with shamans and with modern doctors (p. 1213).
Sebbene il crescente numero di ricerche sull’effetto placebo (o meglio sarebbe, sugli ‘effetti placebo’, visti i diversi meccanismi che sono stati identificati) abbia emancipato il fenomeno dalla mera funzione di controllo in un trial clinico, evidenziandone le molte implicazioni ed alcuni dei percorsi neurali soggiacenti, molto resta ancora da studiare sul fenomeno, tra cui anche gli effetti di una sua più consapevole applicazione terapeutica.
Infine, a mio avviso, la correlazione tra le aspettative nutrite dal paziente e gli effetti di una terapia, emersa dai suddetti studi in ambito medico, suggerisce che tramite analoghi percorsi fisiologici e/o psicologici, potrebbe agire una buona alleanza terapeutica tra clinico e paziente, notoriamente essenziale in ambito psicoterapeutico. Non mi risultano tuttavia studi su quest’ultima ipotesi che riterrei tuttavia degna di essere esplorata.
Riassunto
Solo recentemente la scienza medica si è interessata agli studi che guardano direttamente all’influenza delle aspettative sull’esito di una terapia, e non unicamente ad essa come “tara” da effettuare agli studi su un nuovo trattamento. L’articolo espone i disegni di studio, le limitazioni e le specifiche modalità di ricerca su effetto placebo e effetto nocebo, per poi riassumere brevemente i principali risultati emersi in letteratura. Ne emerge una prospettiva fino a pochi anni fa inedita nel mondo clinico che suggerisce una maggiore attenzione al ruolo delle aspettative che, siano o meno tenute nella dovuta considerazione, nondimeno esercitano la loro influenza in ogni terapia. Il clinico pertanto, diversamente dal ricercatore, lungi dal doverle isolare, diventerebbe semmai più efficace per il paziente sfruttandole adeguatamente.
Bibliografia
Ader, R., & Cohen, N. (1975). Behaviorally conditioned immunosuppression. Psychosomatic Medicine, 37(4), 333–340.
Ader, R., Mercurio, M. G., Walton, J., James, D., Davis, M., Ojha, V., Kimball, A. B., Fiorentino, D. (2010). Conditioned Pharmacotherapeutic Effects: A Preliminary Study. Psychosomatic Medicine, 72(2), 192–197.
Amanzio, M., & Benedetti, F. (1999). Neuropharmacological dissection of placebo analgesia: expectation-activated opioid systems versus conditioning-activated specific subsystems. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 19(1), 484–494.
Amanzio, M., Pollo, A., Maggi, G., & Benedetti, F. (2001). Response variability to analgesics: a role for non-specific activation of endogenous opioids. Pain, 90(3), 205–215.
Andrews, G. (2001). Placebo response in depression: bane of research, boon to therapy. The British Journal of Psychiatry: The Journal of Mental Science, 178, 192–194.
Benedetti, F. (1997). Cholecystokinin Type A and Type B Receptors and Their Modulation of Opioid Analgesia. Physiology, 12(6), 263–268.
Benedetti, F. (2008). Mechanisms of placebo and placebo-related effects across diseases and treatments. Annual Review of Pharmacology and Toxicology, 48, 33–60.
Benedetti, F. (2012). L’effetto placebo. Breve viaggio tra mente e corpo. Roma: Carocci.
Benedetti, F. (2013a). Placebo and the New Physiology of the Doctor-Patient Relationship. Physiological Reviews, 93(3), 1207–1246.
Benedetti, F. (2013b). Responding to nocebos through observation: social contagion of negative emotions. Pain, 154(8), 1165.
Benedetti, F. (2014a). Drugs and placebos: what’s the difference?: Understanding the molecular basis of the placebo effect could help clinicians to better use it in clinical practice. EMBO Reports, 15(4), 329–332.
Benedetti, F. (2014b). Placebo Effects: From the Neurobiological Paradigm to Translational Implications. Neuron, 84(3), 623–637.
Benedetti, F. (2018). La speranza è un farmaco. Come le parole possono vincere la malattia. Milano: Mondadori.
Benedetti, F., Amanzio, M., Baldi, S., Casadio, C., & Maggi, G. (1999). Inducing placebo respiratory depressant responses in humans via opioid receptors. The European Journal of Neuroscience, 11(2), 625–631.
Benedetti, F., Amanzio, M., Casadio, C., Oliaro, A., & Maggi, G. (1997). Blockade of nocebo hyperalgesia by the cholecystokinin antagonist proglumide. Pain, 71(2), 135–140.
Benedetti, F., Amanzio, M., & Maggi, G. (1995). Potentiation of placebo analgesia by proglumide. Lancet, 346(8984), 1231.
Benedetti, F., Arduino, C., Costa, S., Vighetti, S., Tarenzi, L., Rainero, I., & Asteggiano, G. (2006). Loss of expectation-related mechanisms in Alzheimer’s disease makes analgesic therapies less effective. Pain, 121(1-2), 133–144.
Benedetti, F., Pollo, A., Lopiano, L., Lanotte, M., Vighetti, S., & Rainero, I. (2003). Conscious Expectation and Unconscious Conditioning in Analgesic, Motor, and Hormonal Placebo/Nocebo Responses. The Journal of Neuroscience, 23(10), 4315–4323.
Beecher, H. K. (1955). The powerful placebo. Journal of the American Medical Association, 159(17), 1602–1606.
Binger, A. (1918). Über Behandlung der Diphtherie mit gewöhnlichem Pferdeserum. Deutsches Archiv Für Klinische Medizin, 125, 284–332.
Bootzin, R. R., & Caspi, O. (2002). Explanatory mechanisms for placebo effects: cognition, personality and social learning. In H. A. Guess, A. Kleinman, J. W. Kusek, & L. W. Engel (Eds.), The Science of the Placebo: Toward an Interdisciplinary Research Agenda. London: British Medical Journal Book.
Colloca, L., & Benedetti, F. (2005). Placebos and painkillers: is mind as real as matter? Nature Reviews. Neuroscience, 6(7), 545–552.
Colloca, L., Lopiano, L., Lanotte, M., & Benedetti, F. (2004). Overt versus covert treatment for pain, anxiety, and Parkinson’s disease. The Lancet Neurology, 3(11), 679–684.
Cobb, L. A., Thomas, G. I., Dillard, D. H., Merendino, K. A., & Bruce, R. A. (1959). An Evaluation of Internal-Mammary-Artery Ligation by a Double-Blind Technic. New England Journal of Medicine, 260(22), 1115–1118.
De la Fuente-Fernández, R. (2009). The placebo-reward hypothesis: dopamine and the placebo effect. Parkinsonism & Related Disorders, 15, Supplement 3, S72–S74.
Eskendari, F., & Sterberg, E. M. (2002). Neuroendocrine mediators of placebo effects on immunity. In H. A. Guess, A. Kleinman, J. W. Kusek, & L. W. Engel (Eds.), The Science of the Placebo: Toward an Interdisciplinary Research Agenda. London: British Medical Journal Book.
Finniss, D. G., Kaptchuk, T. J., Miller, F., & Benedetti, F. (2010). Biological, clinical, and ethical advances of placebo effects. Lancet, 375(9715), 686–695.
Furmark, T., Appel, L., Henningsson, S., Ahs, F., Faria, V., Linnman, C., Pissiota, A., Frans, O., Bani, M., Bettica, P., Pich, E. M., Jacobsson, E., Wahlstedt, K., Oreland, L., Långström, B., Eriksson, E., & Fredrikson, M. (2008). A link between serotonin-related gene polymorphisms, amygdala activity, and placebo-induced relief from social anxiety. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 28(49), 13066–13074.
Geers, A. L., Helfer, S. G., Kosbab, K., Weiland, P. E., & Landry, S. J. (2005). Reconsidering the role of personality in placebo effects: dispositional optimism, situational expectations, and the placebo response. Journal of Psychosomatic Research, 58(2), 121–127.
Goebel, M. U., Trebst, A. E., Steiner, J., Xie, Y. F., Exton, M. S., Frede, S., Canbay, A. E., Michel, M. C., Heemann, U., Schedlowski, M. (2002). Behavioral conditioning of immunosuppression is possible in humans. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 16(14), 1869–1873.
Guess, H. A., Kleinman, A., Kusek, J. W., & Engel, L. W. (2002). The Science of the Placebo: Toward an Interdisciplinary Research Agenda. London: British Medical Journal Book.
Hahn, R. A. (1985). A Sociocultural Model of Illness and Healing. In L. White, B. Tursky, & G. E. Schwartz (Eds.), Placebo: theory, research and mechanisms (pp. 167–195). New York: Guilford Press.
Hahn, R. A. (1997). The Nocebo Phenomenon: Concept, Evidence, and Implications for Public Health. Preventive Medicine, 26(5), 607–611.
Harrington, A. (2009). The Cure Within: A History of Mind-Body Medicine. New York: W. W. Norton & Company.
Khan, A., Warner, H. A., & Brown, W. A. (2000). Symptom reduction and suicide risk in patients treated with placebo in antidepressant clinical trials: an analysis of the Food and Drug Administration database. Archives of General Psychiatry, 57(4), 311–317.
Klopfer, B. (1957). Psychological variables in human cancer. Journal of Projective Techniques, 21(4), 331–340.
Krummenacher, P., Candia, V., Folkers, G., Schedlowski, M., & Schönbächler, G. (2010). Prefrontal cortex modulates placebo analgesia. Pain, 148(3), 368–374.
Leon, M. B., Kornowski, R., Downey, W. E., Weisz, G., Baim, D. S., Bonow, R. O., Hendel, R. C., Cohen, D. J., Gervino, E., Laham, R., Lembo, N., Moses, J. W., & Kuntz, R. E. (2005). A blinded, randomized, placebo-controlled trial of percutaneous laser myocardial revascularization to improve angina symptoms in patients with severe coronary disease. Journal of the American College of Cardiology, 46(10), 1812–1819.
Mayberg, H. S., Silva, J. A., Brannan, S. K., Tekell, J. L., Mahurin, R. K., McGinnis, S., & Jerabek, P. A. (2002). The Functional Neuroanatomy of the Placebo Effect. American Journal of Psychiatry, 159(5), 728–737.
McKenzie, J. N. (1886). The production of the so-called “rose-cold” by means of an artificial rose. The American Journal of the Medical Sciences, 181, 45–46.
McRae C, Cherin E, Yamazaki T. G., Diem, G., Vo, A. H., Russell, D., Ellgring, J. H., Fahn, S., Greene, P., Dillon, S., Winfield, H., Bjugstad, K. B., & Freed C. R.. (2004). Effects of perceived treatment on quality of life and medical outcomes in a double-blind placebo surgery trial. Archives of General Psychiatry, 61(4), 412–420.
Mercado, R., Constantoyannis, C., Mandat, T., Kumar, A., Schulzer, M., Stoessl, A. J., & Honey, C. R. (2006). Expectation and the placebo effect in Parkinson’s disease patients with subthalamic nucleus deep brain stimulation. Movement Disorders: Official Journal of the Movement Disorder Society, 21(9), 1457–1461.
Miller, F. G. (2004). Sham surgery: An ethical analysis. Science and Engineering Ethics, 10(1), 157–166.
Myers, D. (2012). Social Psychology (11 edition). New York: McGraw-Hill.
Moerman, D. E., & Jonas, W. B. (2002). Deconstructing the Placebo Effect and Finding the Meaning Response. Annals of Internal Medicine, 136(6), 471–476.
Moseley, J. B., O’Malley, K., Petersen, N. J., Menke, T. J., Brody, B. A., Kuykendall, D. H., Hollingsworth, J. C., Ashton, C. M., & Wray, N. P. (2002). A Controlled Trial of Arthroscopic Surgery for Osteoarthritis of the Knee. New England Journal of Medicine, 347(2), 81–88.
Pacheco-López G., Engler H., Niemi MB., & Schedlowski M. (2006). Expectations and associations that heal: Immunomodulatory placebo effects and its neurobiology. Brain, Behavior, and Immunity, 20(5), 430-446.
Petrovic, P., Dietrich, T., Fransson, P., Andersson, J., Carlsson, K., & Ingvar, M. (2005). Placebo in emotional processing–induced expectations of anxiety relief activate a generalized modulatory network. Neuron, 46(6), 957–969.
Pollo, A., Vighetti, S., Rainero, I., & Benedetti, F. (2003). Placebo analgesia and the heart. Pain, 102(1-2), 125–133.
Price, D. D., Milling, L. S., Kirsch, I., Duff, A., Montgomery, G. H., & Nicholls, S. S. (1999). An analysis of factors that contribute to the magnitude of placebo analgesia in an experimental paradigm. Pain, 83(2), 147–156.
Scott, D. J., Stohler, C. S., Egnatuk, C. M., Wang, H., Koeppe, R. A., & Zubieta, J.-K. (2007). Individual Differences in Reward Responding Explain Placebo-Induced Expectations and Effects. Neuron, 55(2), 325–336.
Siegel, S. (2002). Explanatory mechanisms for placebo effects: Pavlovian conditioning. In H. A. Guess, A. Kleinman, J. W. Kusek, & L. W. Engel (Eds.), The Science of the Placebo: Toward an Interdisciplinary Research Agenda. London: British Medical Journal Book.
Swank, D., Swank-Bordewijk, S., Hop, W., van Erp, W., Janssen, I., Bonjer, H., & Jeekel, J. (2003). Laparoscopic adhesiolysis in patients with chronic abdominal pain: a blinded randomised controlled multi-centre trial. The Lancet, 361(9365), 1247–1251.
Temple, R. J. (2002). Placebo controlled trials and active controlled trials: ethics and inference. In H. A. Guess, A. Kleinman, J. W. Kusek, & L. W. Engel (Eds.), The Science of the Placebo: Toward an Interdisciplinary Research Agenda. London: British Medical Journal Book.
Tröhler, U. (2011). Adolf Bingel’s blinded, controlled comparison of different anti-diphtheritic sera in 1918. Journal of the Royal Society of Medicine, 104(7), 302–305.
Vase, L., Robinson, M. E., Verne, G. N., & Price, D. D. (2005). Increased placebo analgesia over time in irritable bowel syndrome (IBS) patients is associated with desire and expectation but not endogenous opioid mechanisms. Pain, 115(3), 338–347.
Vögtle, E., Barke, A., & Kröner-Herwig, B. (2013). Nocebo hyperalgesia induced by social observational learning. Pain, 154(8), 1427–1433.
Volkow, N. D., Wang, G.-J., Ma, Y., Fowler, J. S., Zhu, W., Maynard, L., Telang, F., Vaska, P., Ding, Y., Wong, C., & Swanson, J. M. (2003). Expectation enhances the regional brain metabolic and the reinforcing effects of stimulants in cocaine abusers. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 23(36), 11461–11468.
Voudouris, N. J., Peck, C. L., & Coleman, G. (1990). The role of conditioning and verbal expectancy in the placebo response. Pain, 43(1), 121–128.
Walsh, B. T., Seidman, S. N., Sysko, R., & Gould, M. (2002). Placebo response in studies of major depression: variable, substantial, and growing. JAMA, 287(14), 1840–1847.
World Medical Association. (2013). World medical association declaration of Helsinki: Ethical principles for medical research involving human subjects. JAMA, 310(20), 2191–2194.

